¡Tu carrito está actualmente vacío!
Una enzima antioxidante tiene funciones secundarias
Uno de los grandes problemas que han surgido en la biología molecular es que algunos genes no son lo que parecen ser y otros que son claramente algo con una función definida, resulta que tienen otras funciones. Parece un trabalenguas lo anterior, pero ni más ni menos ese es el problema biológico: proteínas que tienen una actividad clara en un compartimento celular y cuando por un mecanismo no descrito se van a otro compartimento, tienen una actividad totalmente nueva. Este fenómeno se le llama proteínas moonlighting, proteínas con funciones duales.
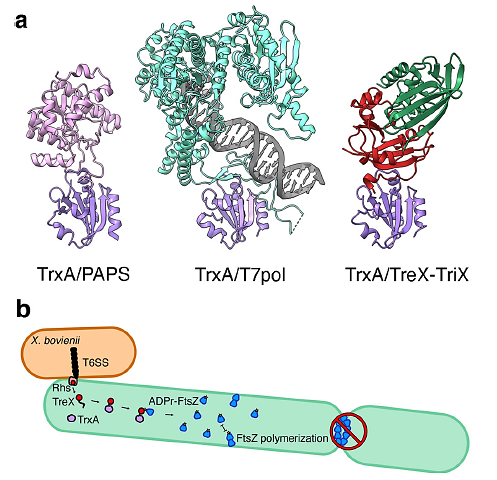
El pasado 29 de noviembre, un artículo en Nature Communications [1] reporta un hallazgo relacionado con funciones duales de proteínas. Cuando las bacterias se enfrentan a estrés oxidativo, tienen un arsenal muy grande de proteínas para enfrentarlo. Un efecto de la exposición con agentes oxidantes es que los puentes disulfuro en las proteínas pueden romperse y eso afectar su actividad bioquímica. Un componente de la respuesta a este tipo de daños son las tiorredoxinas (TrxA siendo la más importante) que son proteínas pequeñas muy conservadas en bacterias. Los autores demostraron que TrxA, la tiorredoxina principal bacteriana, se asocia a otra proteína que es una ADP ribosil transferasa (TreX) que es una proteína secretada tóxica en la bacteria Xenorhabdus bovienii y carece de cisteínas y se une al carboxilo terminal de TrxA, expandiendo su función al unirse a esta proteína mediante el control de la división celular. Este estudio es muy relevante, ya que este tipo de toxinas (TreX) están conservadas en muchas bacterias que son patógenas para varias especies. En este caso, esta bacteria ataca a otras bacterias y en el caso de Escherichia coli, la toxina induce filamentación. Pero este no es el único caso de bacterias que provocan con una ADP ribosil transferasa efectos celulares, en la literatura hay muchos casos de este tipo de efectos celulares en células de mamíferos.
Adicionalmente, es el primer caso de una toxina bacteriana que se ha demostrado tener una activación en el citoplasma bacteriano previo a su secreción y que se mantenga estable previo a realizar su función, lo que los autores demostraron se debe a que TrxA su función secundaria además de mantener el estado redox de sus proteínas blanco, es también de chaperona. Este trabajo sugiere que otras proteínas asociadas al proceso patogénico en bacterias tiene relación con proteínas que mantienen las condiciones internas saludables y que podrían ser nuevos blancos terapéuticos.

Referencia
[1] Dumont B, Terradot L, Cascales E, Van Melderen L, Jurėnas D. Thioredoxin 1 moonlights as a chaperone for an interbacterial ADP-ribosyltransferase toxin. Nat Commun. 2024 Nov 29;15(1):10388. doi: 10.1038/s41467-024-54892-w.
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.