¡Tu carrito está actualmente vacío!
¿Cómo se ensamblan las proteínas en la célula?
Cuando estudiamos bioquímica y biología celular, es muy difícil comprender como tantos elementos se ensamblan dentro de las células y, sobre todo, cuando sabemos que las proteínas son medio caprichosas, cuando son purificadas, cómo le hacen para ser más estables dentro de la célula.
Este problema es aún más complejo, porque si recordamos el modelo de cómo se producen las proteínas en células con núcleo, primero ocurre la transcripción, luego el ARN mensajero sale del núcleo (previamente siendo procesado) y es traducido en el citoplasma, entonces, ¿cómo se forman los complejos que tantos dolores de cabeza nos hicieron pasar en bioquímica?
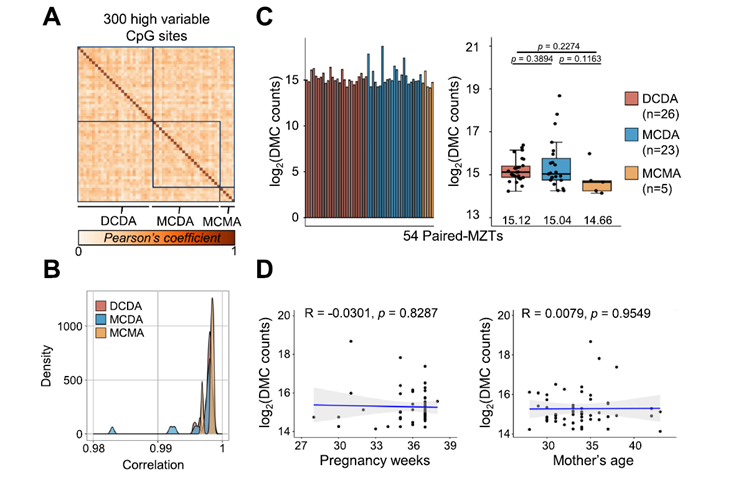
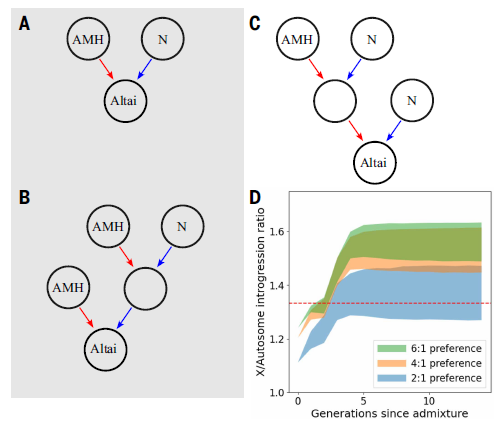
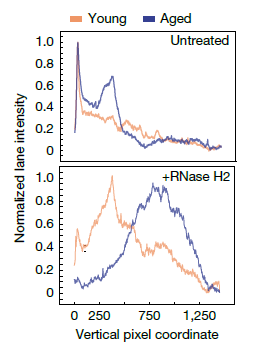
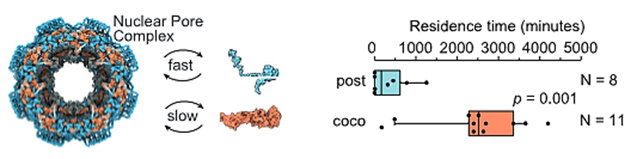
En un artículo reciente de la revista Cell [1] presentan un primer intento de determinar cómo se forman los complejos funcionales de proteínas usando diferentes métodos, entre ellos, el favorito de Biología Molecular México, la AI AlphaFold2. El trabajo aborda como la co-traducción, es decir, que se traducen simultáneamente y cómo este proceso resulta en la cooperatividad del plegamiento de las proteínas que formarán un complejo funcional en la célula. En un trabajo publicado previo, se encontró que había marcas de proteínas que quedaban protegidas de degradación al estar unidos dos ribosomas por proteínas que recién son sintetizadas. En este trabajo usando información de proteínas que interactúan recién son sintetizadas, pudieron determinar que existen evidencias de regiones en proteínas que son necesarias para formar estos complejos que están hechos de proteínas diferentes, tanto de manera teórica con modelos a partir de datos experimentales de proteínas protegidas por ser co-traducidas como por la co-localización de ARN mensajeros que producen proteínas de estos complejos. La cuestión que queda por resolver es ¿cómo pueden co-localizar ribosomas que tienen el ARN mensajero que corresponde a la subunidad que se va a producir? Los autores sugieren que pueden tener algún tipo de secuencia como un código postal que les permiten formar complejos particulados en el citoplasma celular, esto es consistente con los datos que proporcionan usando localización del ARN mensajero. Este artículo lo queríamos destacar para ustedes porque es una de las preguntas fundamentales en la naturaleza, cómo se conservan las estructuras y secuencias de proteínas y cómo esto tiene una relación en el Dogma Central de la Biología Molecular, en el cual si bien el flujo de la información genética termina con la producción de una proteína, cómo la estructura de esta está relacionada con la función en ese mundo tan saturado al interior de una célula y se establecen los complejos altamente organizados que dan función a la célula.

Las limitaciones de este estudio radican en 1, se analiza un grupo de ARN mensajeros que forman pares en ribosomas, pero no cómo ocurre con complejos que están hechos de una sola proteína. 2, no se hizo un análisis detallado de complejos hechos de una sola proteína, es decir, el segundo paso mencionado en el punto 1. Y 3, no se sabe qué dirige a la co-localizar los ribosomas que producen proteínas que forman un complejo. Estaremos atentos a trabajos que continúan explorando estas relaciones funcionales en proteínas que forman complejos.
Referencia
[1] Mallik S, Venezian J, Lobov A, Heidenreich M, Garcia-Seisdedos H, Yeates TO, Shiber A, Levy ED. Structural determinants of co-translational protein complex assembly. Cell. 2024 Dec 18:S0092-8674(24)01330-8. doi: 10.1016/j.cell.2024.11.013.
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.