¡Tu carrito está actualmente vacío!
¡Cortar y Pegar Proteínas! Presentan una Nueva y Poderosa Técnica para Editar las Moléculas de la Vida
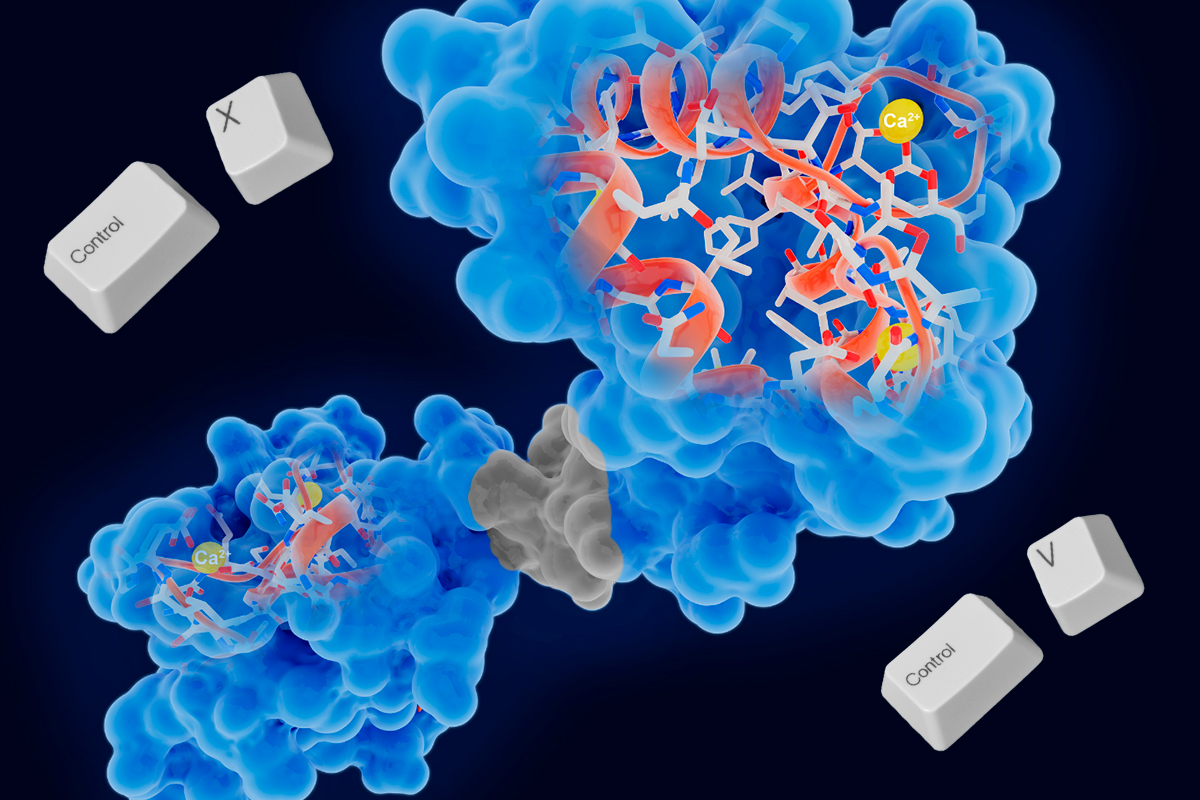
Las proteínas son las máquinas moleculares de la vida. Entender cómo funcionan es fundamental, y para ello, los científicos a menudo necesitan modificarlas: añadirles etiquetas, cambiar piezas, introducir sondas como proteínas fluorescentes entre otras. Sin embargo, editar proteínas, especialmente en su interior o cuando ya están plegadas en su forma funcional tridimensional, ha sido un desafío enorme. Las técnicas tradicionales, que implican cortar la proteína en pedazos y luego volver a unirlos (semisíntesis), a menudo requieren que la proteína se despliegue y luego se vuelva a plegar correctamente, un proceso que no funciona para muchas proteínas complejas o ensamblajes de múltiples subunidades.
Pero ahora, un equipo de químicos biológicos liderado por Tom W. Muir en la Universidad de Princeton ha desarrollado una ingeniosa solución, publicada en Science [1]. Inspirándose en un proceso natural del ADN, han creado un método robusto para realizar una cirugía molecular precisa: un verdadero “cortar y pegar” directamente sobre proteínas plegadas.
La Técnica: Transposición de Proteínas Mediada por Inteínas
El método se inspira en la transposición del ADN, donde secuencias genéticas pueden “saltar” de un lugar a otro del genoma. Pero en lugar de usar enzimas que cortan y pegan ADN, esta nueva técnica utiliza pares de inteínas divididas (split inteins) diseñadas inteligentemente. Las inteínas son secuencias de proteínas con la asombrosa capacidad natural de auto escindirse de una proteína precursora y, al mismo tiempo, unir los fragmentos flanqueantes. Las inteínas divididas son versiones de estas que vienen en dos mitades inactivas, pero que, al encontrarse, pueden reconstituir su actividad de “corte y empalme” (protein trans-splicing o abreviado a PTS).
Así es como funciona la “transposición de proteínas”:
- La Proteína Receptora: Se modifica genéticamente la proteína que se desea editar. En el lugar donde se quiere hacer el cambio, se insertan dos “sitios de acoplamiento” especiales. Estos sitios consisten en una mitad de una inteína dividida A (llamémosla IntA<sup>N</sup>) y una mitad de una inteína dividida B diferente (IntB<sup>C</sup>), separadas por la secuencia que se desea reemplazar. Es crucial que las inteínas A y B sean “ortogonales”, es decir, que la mitad de A solo reaccione con la otra mitad de A, y no con la de B.

- El “Transposón” Donador: Se crea un fragmento de proteína (el “transposón”) que contiene la nueva pieza que se quiere insertar (puede ser una etiqueta, una modificación química, un péptido diferente, ¡incluso un polímero sintético!). Este fragmento está flanqueado por las mitades complementarias de las inteínas usadas en el receptor (IntA<sup>C</sup> e IntB<sup>N</sup>). Estas son las “llaves” que encajarán en los “sitios de acoplamiento”.
- La Reacción de “Cortar y Pegar”: Se mezclan la proteína receptora (ya plegada y funcional) y el transposón donador en condiciones fisiológicas (acuosas, pH neutro). ¡Aquí ocurre la magia! Las mitades de inteína complementarias se encuentran y se unen (IntAN con IntAC, e IntBN con IntBC). En una reacción coordinada, las inteínas realizan su función de corte y empalme:
- Cortan la secuencia original flanqueada por las inteínas en la proteína receptora.
- Pegan el nuevo fragmento del transposón donador exactamente en su lugar.
- Todo esto sucede en un solo paso y sobre la proteína ya plegada, sin necesidad de desnaturalizarla ni replegarla y mejor aún, sin necesidad de complejas moléculas de ADN que pueden ser inestables o recombinen.
Un punto clave que optimizaron los investigadores fue encontrar pares de inteínas (como las llamadas Cat y mut-Cfa) cuyas velocidades de reacción fueran muy similares. Esto asegura que el proceso sea coordinado, evitando que se acumulen productos intermedios parcialmente cortados o pegados, lo que aumenta enormemente la eficiencia y el rendimiento de la edición.
Demostrando su Poder y Versatilidad
El equipo demostró la potencia de esta técnica en varios sistemas impresionantes:
- Editaron la proteína fluorescente verde (eGFP) insertando una etiqueta en su interior sin perder su fluorescencia, indicando que la proteína permaneció correctamente plegada durante el proceso.
- Modificaron con éxito una proteína mucho más grande y compleja, la dCas9 (una versión inactiva de la famosa herramienta de edición genética CRISPR), insertando incluso un polímero sintético (PEG) en su estructura, demostrando la capacidad de introducir elementos no naturales.

- Aplicaron la técnica a un complejo multiproteico (el complejo remodelador de cromatina ACF), modificando específicamente una de sus subunidades (SMARCA5) para estudiar cómo ciertas modificaciones químicas (como la fosforilación) o la inserción de sondas (como un entrecruzador fotoactivable) afectan su función biológica.

- Incluso mostraron que la reacción puede funcionar dentro de núcleos celulares aislados y potencialmente en células vivas.
Importancia Revolucionaria
Esta técnica de transposición de proteínas representa un avance significativo por varias razones:
- Supera Limitaciones Clave: Permite editar regiones internas de proteínas que antes eran inaccesibles.
- Funciona en Proteínas Plegadas: Evita el problemático paso de replegamiento, ampliando enormemente el rango de proteínas y complejos que pueden ser modificados, ya que obtener una proteína plegada después de su desnaturalización es un gran reto y no en todas las proteínas esto es posible.
- Alta Eficiencia y “Limpieza”: El proceso coordinado minimiza subproductos y funciona en un solo paso bajo condiciones suaves.
- Gran Versatilidad: Permite insertar una amplia gama de elementos, desde péptidos naturales hasta modificaciones químicas precisas o polímeros sintéticos.
En resumen, el equipo de Muir nos ha entregado un nuevo y poderoso juego de “tijeras y pegamento” molecular para proteínas. Esta herramienta abre puertas fascinantes para la investigación fundamental, permitiendo a los científicos sondear la función proteica con una precisión sin precedentes, y tiene un enorme potencial para el diseño de nuevas terapias, diagnósticos y biomateriales.
Referencia
[1] Hua Y, Tay NES, Ye X, Owen JA, Liu H, Thompson RE, Muir TW. Protein editing using a coordinated transposition reaction. Science. 2025 Apr 4;388(6742):68-74. doi: 10.1126/science.adq8540.
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.