¡Tu carrito está actualmente vacío!
¡Cortocircuito Celular! Cómo la Toxina TisB de E. coli Apaga el Motor de Protones Tras el Ataque de Antibióticos
Las bacterias, como la famosa Escherichia coli, son maestras de la supervivencia. Enfrentadas a estrés, como el daño a su ADN causado por ciertos antibióticos (por ejemplo, las quinolonas como el ácido nalidíxico o la ciprofloxacina), activan una compleja red de respuestas de emergencia conocida como la respuesta SOS. Dentro de esta respuesta, a menudo se producen pequeñas proteínas conocidas como toxinas, que forman parte de sistemas toxina-antitoxina (TA). Estos sistemas son como interruptores genéticos: la antitoxina normalmente mantiene a raya a la toxina, pero bajo estrés, la toxina puede liberarse y actuar de muchas maneras, incluso se ha demostrado que son sistemas de resistencia a fagos o virus que infectan bacterias.
Muchas de estas toxinas de Tipo I son péptidos hidrofóbicos que se insertan en la membrana celular. Se sospechaba que podían alterar la “batería” de la célula, la Fuerza Protón Motriz (PMF), que es esencial para generar energía (ATP) y muchas otras funciones vitales. La PMF tiene dos componentes: un gradiente eléctrico (diferencia de cargas a través de la membrana) y un gradiente de protones (diferencia de pH). Alterar la PMF podría ser una estrategia bacteriana para entrar en un estado de latencia o “persistencia”, volviéndose tolerante a los antibióticos.
Un estudio publicado en Scientific Reports por Tekle Airgecho Lobie, James Alexander Booth y colegas de Noruega, profundiza en el papel específico de estas toxinas Tipo I en la alteración de la PMF tras el daño al ADN inducido por antibióticos.
La Pregunta Clave: ¿Quién Apaga Qué?
Se sabía que la toxina TisB, inducida por la respuesta SOS, juega un papel importante. Estudios previos habían demostrado que las bacterias mutantes para tisB tenían problemas para despolarizar su membrana y formar células persistentes (persisters, que es una pequeña población de células resistentes a antibióticos y otros tipos de estrés) después del tratamiento con quinolonas. Pero ¿es TisB la única responsable? ¿Y qué componente de la PMF afecta principalmente: el eléctrico o el de protones (pH)?
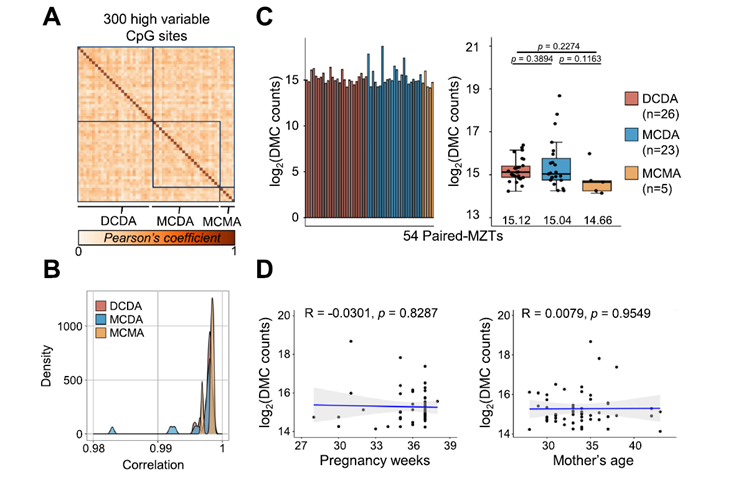
Los investigadores utilizaron técnicas sofisticadas de citometría de flujo y reporteros fluorescentes para medir ambos componentes de la PMF en E. coli después de tratarla con ácido nalidíxico en condiciones ligeramente ácidas (pH 5.7), que imitan algunos entornos naturales de la bacteria y permiten estudiar mejor el gradiente de pH. Examinaron no solo mutantes de tisB, sino también de otras toxinas Tipo I inducidas por SOS (como DinQ) y otras no directamente reguladas por SOS pero relacionadas.

El Hallazgo Sorprendente: TisB Tiene el Control Exclusivo del pH
Los resultados fueron reveladores:
- Gradiente Eléctrico – Un Asunto Complicado: Varias toxinas de Tipo I, incluyendo TisB, DinQ e IbsA, parecieron influir en la despolarización eléctrica de la membrana (medida con la sonda DiBAC₄(3)). La eliminación de tisB o dinQ mostró efectos sinérgicos, sugiriendo que diferentes toxinas podrían afectar distintos aspectos de las cargas eléctricas a través de la membrana.

- Gradiente de Protones – ¡El Dominio Exclusivo de TisB!: Aquí vino la gran sorpresa. De todas las toxinas estudiadas, SOLAMENTE TisB fue responsable de la disipación del gradiente de protones (el colapso de la diferencia de pH). Los mutantes tisB eran completamente incapaces de equilibrar su pH interno con el externo después del daño al ADN, manteniendo su pH interno alcalino (homeostasis). En contraste, eliminar otras toxinas como dinQ o agrB (su antitoxina) no tuvo ningún efecto significativo sobre la disipación del pH.
- Consecuencias del Control de pH: Esta incapacidad de los mutantes tisB para colapsar el gradiente de protones tuvo consecuencias. Mantuvieron una respuesta SOS más prolongada y, crucialmente, mostraron tasas de mutagénesis significativamente mayores a pH bajo, comparado con las bacterias normales. Esto sugiere que colapsar el gradiente de pH (mediado por TisB) normalmente ayuda a “calmar” la respuesta SOS y a reducir las mutaciones potencialmente peligrosas.
¿Por Qué Importa? El Interruptor de Supervivencia
Este estudio demuestra que la respuesta al daño del ADN en E. coli implica una disipación diferenciada de los componentes de la PMF. Mientras que varias toxinas pueden “jugar” con el potencial eléctrico, TisB actúa como un interruptor maestro específico para colapsar el gradiente de protones.
Los autores proponen que este colapso del gradiente de protones, inducido por TisB, es un paso clave en la formación de células persistentes. Al reducir drásticamente la PMF (especialmente su componente químico, el ΔpH), la célula disminuye su actividad metabólica y su producción de ATP, entrando en un estado de latencia que la protege de la acción de antibióticos que requieren que la bacteria esté activa para matarla.
Entender este mecanismo a nivel molecular, identificando a TisB como el actor clave en la manipulación del gradiente de pH, es fundamental para comprender cómo las bacterias sobreviven al estrés antibiótico y desarrollan tolerancia. Abre nuevas vías para pensar en estrategias que puedan interferir con este “interruptor de supervivencia” y hacer que los antibióticos sean más efectivos.

Referencia: Lobie, T.A., Krog, C.S., Skarstad, K. et al. Escherichia coli type I toxin TisB exclusively controls proton depolarization following antibiotic induced DNA damage. Sci Rep 15, 12774 (2025). https://doi.org/10.1038/s41598-025-96136-x
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.