¡Tu carrito está actualmente vacío!
El Doble Filo de una Bacteria Intestinal: Cómo la E. coli productora de Colibactina Impulsa el Cáncer Colorrectal y Desafía las Terapias
El Cáncer Colorrectal y un Actor Microscópico Clave
El cáncer colorrectal (CCR) es un desafío de salud global de primer orden, con una incidencia preocupantemente en aumento, sobre todo en personas menores de 50 años. Si bien los factores del estilo de vida y la dieta son contribuyentes conocidos, la evidencia científica apunta cada vez más hacia un protagonista inesperado que reside en nuestro propio intestino: la microbiota. Entre la compleja comunidad de microorganismos intestinales, una cepa particular de Escherichia coli (E. coli) ha emergido como un actor clave en la iniciación y progresión del CCR. Se trata de la E. coli portadora del islote de patogenicidad pks (pks+ E. coli), que produce una potente genotoxina llamada colibactina. Un nuevo artículo de revisión publicado en Trends in Microbiology por Maude Jans y Lars Vereecke profundiza en los intrincados mecanismos a través de los cuales esta bacteria no solo daña el ADN, sino que también manipula su entorno para prosperar e influir en la respuesta al tratamiento del cáncer.
La Colibactina: Un Arma de Doble Filo con Firma Genética
La colibactina es una molécula compleja y químicamente inestable que causa daño directo al ADN de las células huésped, induciendo roturas y entrecruzamientos en la doble hélice. Este daño no es aleatorio; la colibactina deja una “firma mutacional” distintiva (conocida como SBS88) que se ha encontrado hasta en uno de cada ocho tumores de colon, vinculando directamente la genotoxicidad bacteriana con el desarrollo del cáncer.
Curiosamente, el islote pks también codifica un gen de auto-resistencia, clbS, que protege a la propia bacteria de los efectos tóxicos de la colibactina. Esto sugiere que, si bien la colibactina daña el ADN humano como un “efecto colateral”, su función ecológica principal podría ser la competencia interbacteriana, eliminando a rivales en el complejo ecosistema intestinal. De hecho, la colibactina también daña el ADN de otras bacterias, lo que podría promover la diversidad genética y la adaptación bacteriana.

El Entorno Favorable: Cómo la Inflamación y el Tumor “Alimentan” a pks+ E. coli
El artículo destaca que la pks+ E. coli no actúa en el vacío. Diversos factores fisiológicos y ambientales en el intestino pueden promover su expansión y la exposición a la colibactina:
- Barrera de Mucus Comprometida: En un intestino sano, una capa de mucus protege el epitelio. Sin embargo, la inflamación (como en la enfermedad inflamatoria intestinal, EII) o una dieta occidental (baja en fibra) pueden debilitar esta barrera, permitiendo que pks+ E. coli se adhiera más fácilmente a las células epiteliales, un requisito para que la colibactina ejerza su efecto genotóxico.
- Disponibilidad de Oxígeno: Aunque la producción de colibactina es máxima en condiciones anaeróbicas (sin oxígeno), la inflamación puede aumentar la oxigenación epitelial, favoreciendo la expansión de bacterias facultativamente anaerobias como E. coli. Estos “blooms” bacterianos podrían ser particularmente dañinos en contextos de inflamación recurrente.
- Hierro: La inflamación reduce la absorción intestinal de hierro y el daño tisular lo libera, creando un ambiente rico en este nutriente que favorece la proliferación de E. coli. Irónicamente, altas concentraciones de hierro suprimen la producción de colibactina, permitiendo a la bacteria priorizar el crecimiento. Cuando el hierro escasea, E. coli puede reactivar la producción de colibactina para asegurar su persistencia.
- Muerte Celular Epitelial: La inflamación y el cáncer aumentan la muerte de células epiteliales. Estas células moribundas liberan nutrientes (aminoácidos, poliaminas) que no solo alimentan a E. coli, sino que también pueden influir en la producción de colibactina, creando un círculo vicioso.
- Adhesión Específica: pks+ E. coli utiliza adhesinas específicas (como FimH y FmlH) para unirse a glicoproteínas alteradas en la superficie de las células epiteliales inflamadas o cancerosas (como CEACAM6). Esta adhesión es crucial para posicionar la colibactina cerca del ADN del huésped.

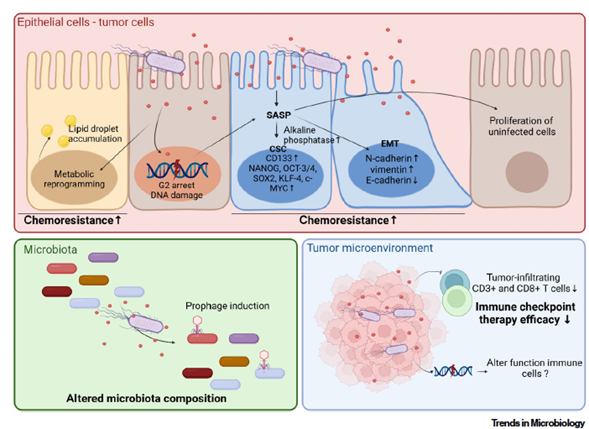
Más Allá del Daño al ADN: Impacto en la Progresión del Cáncer y la Terapia
Los efectos de pks+ E. coli van más allá de la simple genotoxicidad, impactando la biología del tumor y la respuesta a los tratamientos:
- Senescencia y Células Madre Cancerosas: La colibactina puede inducir senescencia en las células dañadas, un estado donde secretan factores que, paradójicamente, pueden promover el crecimiento de células madre cancerosas resistentes y el desarrollo de resistencia a la quimioterapia.
- Metabolismo Tumoral: Las células epiteliales expuestas a colibactina reprograman su metabolismo, acumulando gotas de lípidos que pueden servir como fuente de energía para las células tumorales durante la quimioterapia y, además, reducir la infiltración de células T CD8+ inmunosupresoras.
- Resistencia a la Inmunoterapia: Aunque el daño al ADN podría generar neoantígenos que activen la respuesta inmune, los tumores positivos para pks+ E. coli son en su mayoría microsatélite estables (MSS), con baja carga mutacional. De hecho, la infección por pks+ E. coli se asocia con un microambiente tumoral más inmunosupresor y una menor eficacia de la inmunoterapia con inhibidores de puntos de control (ICI), al menos en modelos preclínicos.
- Modulación de la Microbiota: La colibactina puede inducir la activación de profagos en otras bacterias, alterando la composición de la microbiota y potencialmente aumentando la prevalencia de otras bacterias proinflamatorias u oncogénicas.

Implicaciones Terapéuticas y Preguntas Pendientes
Comprender estos mecanismos abre la puerta a nuevas estrategias terapéuticas, como inhibir la biosíntesis de colibactina, bloquear la adhesión bacteriana, o incluso usar vacunas o terapia con fagos. Sin embargo, la revisión también subraya la necesidad de cautela, por ejemplo, al usar cepas probióticas de E. coli (como E. coli Nissle 1917) que también portan el islote pks, sugiriendo el uso de variantes deficientes en colibactina para mayor seguridad.
El artículo concluye resaltando que, a pesar de los avances, muchas preguntas cruciales permanecen, como la dinámica exacta de la exposición a colibactina a lo largo de la vida, los factores específicos que regulan su producción in vivo, y su papel en cánceres extraintestinales (vejiga, próstata, oral), donde también se ha detectado su firma.
Los invitamos a revisar una plática en vivo que se dio en Facebook en la página de Biología Molecular México en la que se comentó sobre un artículo que describe una forma de editar in vivo el microbioma, quizá una esperanza para combatir este tipo de efectos de la colibactina.
Referencia del Artículo de Revisión:
Jans, M., & Vereecke, L. (2025). Physiological drivers of pks+ E. coli in colorectal cancer. Trends in Microbiology, xx(xx). https://doi.org/10.1016/j.tim.2025.04.010
(Nota: El volumen y número de página exactos (xx) serán definidos en la publicación final, ya que este es un “Artículo en Prensa”).
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.