¡Tu carrito está actualmente vacío!
La Disrupción Metabólica y el Daño Intestinal Durante la Privación de Sueño
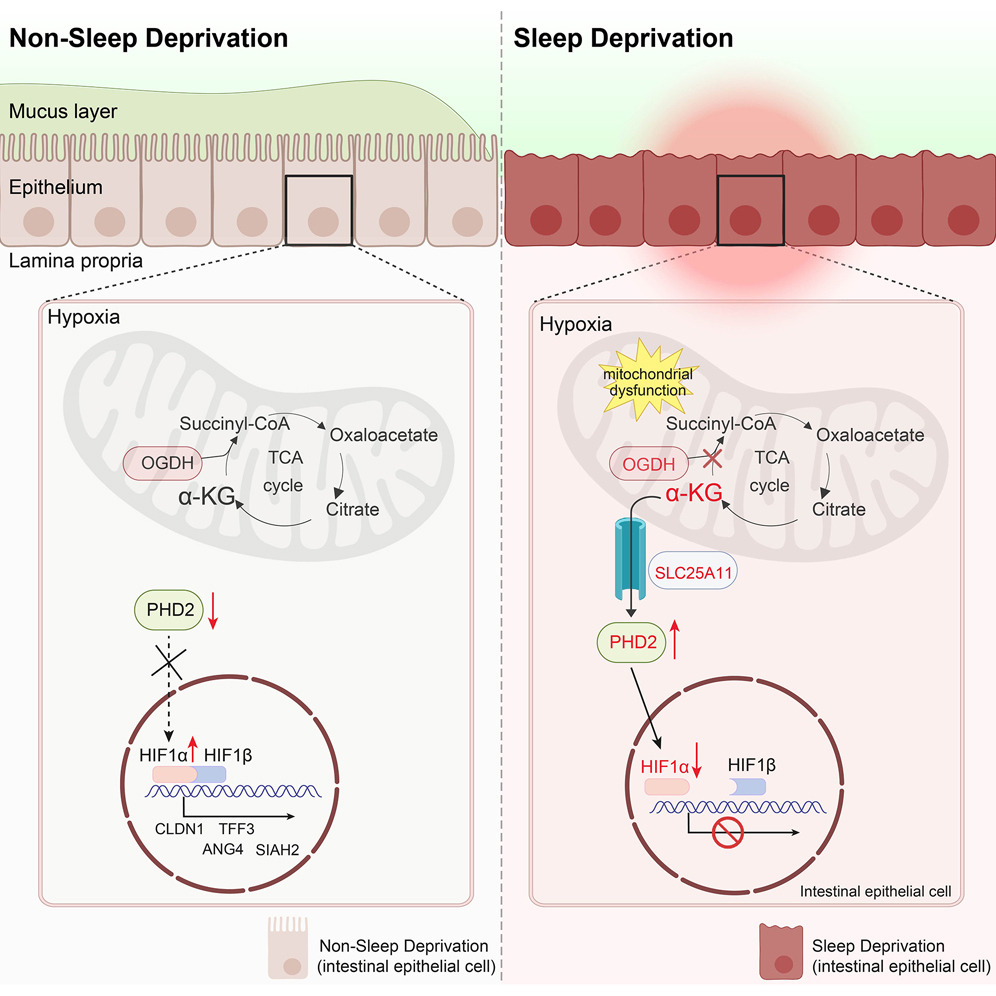
La privación de sueño (SD, por sus siglas en inglés) afecta negativamente diversos procesos metabólicos en el organismo, aumentando el riesgo de enfermedades metabólicas e inmunológicas como obesidad, diabetes y enfermedades cardiovasculares. Además, SD está asociada con la aceleración de enfermedades inflamatorias intestinales y el daño intestinal, que se ha relacionado con el aumento de especies reactivas de oxígeno (ROS) y la interrupción de la liberación de melatonina.
El epitelio intestinal, caracterizado por su “hipoxia fisiológica” y alta resistencia a bajos niveles de oxígeno, depende en gran medida de la respuesta regulada por el factor inducible por hipoxia HIF1α para la reparación y el mantenimiento de la integridad de la barrera intestinal. La pérdida de HIF1α durante condiciones de hipoxia impide la activación de genes clave como TFF3 y CLDN1, los cuales protegen la barrera intestinal. Sin embargo, en condiciones de SD, se observó que la acumulación de metabolitos en el ciclo de Krebs, especialmente α-cetoglutarato (αKG), aumentaba la actividad de la enzima PHD2. Este incremento en PHD2 inhibía a HIF1α, lo que resultaba en un daño intestinal agravado y una reducción en la capacidad de reparación del intestino.
En este estudio, el análisis transcriptómico de colones de ratones privados de sueño mostró que la acumulación de αKG activaba PHD2, afectando negativamente la capacidad de HIF1α para responder a la hipoxia y mantener la integridad de la barrera intestinal. Estos resultados sugieren que balancear los procesos metabólicos o acelerar los mecanismos de reparación intestinal podría mitigar el daño intestinal asociado con la privación de sueño.
https://doi.org/10.1016/j.celrep.2024.114915

AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.