¡Tu carrito está actualmente vacío!
La Memoria de las Vacunas Tiene Dirección: Descubren por Qué Importa Dónde Recibes el Refuerzo
Cuando recibimos una vacuna, nuestro sistema inmunitario genera una “memoria” en forma de células especializadas, incluyendo las células B de memoria (Bmems). Estas células son cruciales porque, si nos volvemos a exponer al patógeno (o recibimos una dosis de refuerzo), pueden reactivarse rápidamente para producir anticuerpos protectores. Pero ¿cómo “recuerdan” y se reactivan estas células de memoria de la forma más eficaz?
Un nuevo estudio, publicado en la prestigiosa revista Cell, revela un factor sorprendente y previamente subestimado: la ubicación de estas células B de memoria dentro del cuerpo y el lugar donde se administra la dosis de refuerzo determinan drásticamente la calidad y rapidez de la respuesta inmune.
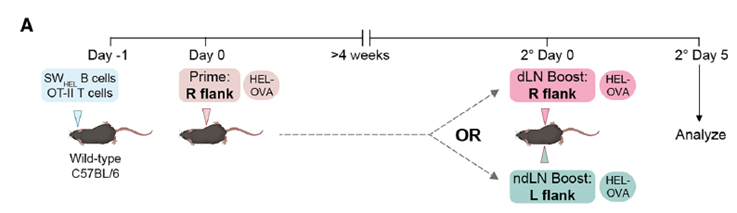
Investigadores del Instituto Garvan de Investigación Médica, el Instituto Kirby y colaboradores utilizaron modelos animales y analizaron muestras de participantes humanos vacunados contra el SARS-CoV-2 para desentrañar este fenómeno:
- Memoria Local vs. Circulante: Descubrieron que, tras la vacunación inicial, se forman dos tipos principales de Bmems: unas que residen cerca del sitio de la inyección, en el ganglio linfático que “drenó” la vacuna (el ganglio linfático drenante o dLN), y otras que circulan por el cuerpo y pueden encontrarse en otros ganglios (no drenantes o ndLN).

- Destinos Diferentes: ¡Estas células se comportan de manera muy distinta al recibir un refuerzo!
- Las Bmems residentes en el dLN tienden a reingresar a los centros germinales (GCs). Los GCs son como “campos de entrenamiento avanzado” donde las células B pueden mutar y mejorar aún más la afinidad y especificidad de sus anticuerpos.
- Las Bmems circulantes en los ndLN tienden a diferenciarse directamente en células plasmáticas, que son “fábricas” de anticuerpos, pero producen anticuerpos basados en la “memoria” inicial, sin pasar por la mejora adicional de los GCs.

- Los Macrófagos como Directores: El estudio identificó a unas células inmunitarias clave en este proceso: los macrófagos del seno subcapsular (SSMs), situados justo debajo de la cápsula del ganglio linfático. En el dLN (pero no necesariamente en el ndLN), estos SSMs, que ya fueron “cebados” por la primera vacuna, parecen retener físicamente a las Bmems residentes y dirigirlas activamente hacia los GCs tras el refuerzo. Cuando eliminaron experimentalmente estos macrófagos, las Bmems del dLN perdieron su preferencia por reingresar a los GCs.
- Implicación Práctica (Humanos y Vacuna COVID-19): ¡Estos hallazgos se confirmaron en humanos! Analizaron la respuesta a la segunda dosis (refuerzo) de la vacuna BNT162b2 contra el COVID-19. Las personas que recibieron el refuerzo en el mismo brazo que la primera dosis (activando las Bmems residentes del dLN) generaron una secreción más rápida y anticuerpos neutralizantes de espectro más amplio (más eficaces contra variantes) en la primera semana, comparado con quienes recibieron el refuerzo en el brazo opuesto (activando principalmente Bmems circulantes en ndLN).

Conclusión: Una Estrategia Inesperada para Mejorar Vacunas
Este estudio revela un papel crucial y dependiente de la localización para los macrófagos SSM en dirigir el destino de las células B de memoria. Demuestra que el “cebado” del ganglio linfático local por la vacunación inicial crea un nicho especializado que favorece una mejor respuesta de memoria (más rápida, más diversa y con mayor potencial de adaptación a variantes) si el refuerzo se administra en el mismo sitio.
Estos hallazgos tienen implicaciones directas para optimizar las estrategias de vacunación, sugiriendo que administrar las dosis de refuerzo en el mismo lugar que la primo vacunación podría generar una inmunidad más robusta y duradera, especialmente en situaciones donde se necesita una respuesta rápida y amplia contra patógenos que mutan constantemente.
Referencia: Dhenni, R., Hoppé, A.C., Reynaldi, A., et al. (2025). Macrophages direct location-dependent recall of B cell memory to vaccination. Cell, 188, 1–20. DOI: 10.1016/j.cell.2025.04.005 (Nota: El DOI y fecha exacta de publicación final pueden variar)
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.