¡Tu carrito está actualmente vacío!
La Paradoja del Cáncer: Su ADN “Extra” Necesita Dañarse para Persistir
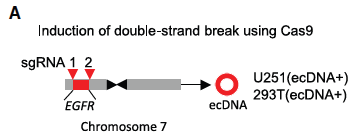
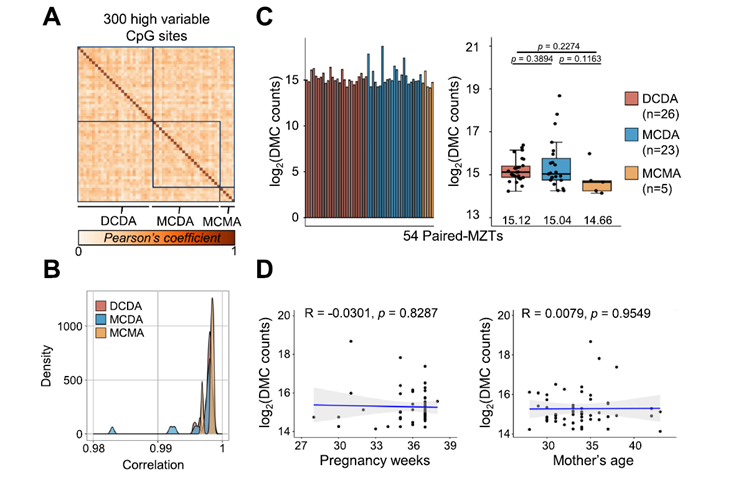
Algunos de los cánceres más agresivos y resistentes a tratamientos tienen un secreto genético peculiar: además de sus cromosomas normales, sus células albergan pequeños círculos de ADN llamados ADN extracromosómico (ecDNA). Estas “islas genéticas flotantes” a menudo contienen múltiples copias de genes clave que impulsan el crecimiento del tumor (oncogenes), permitiendo al tumor adaptarse rápidamente. Pero ¿cómo logran estas estructuras de ecDNA, que carecen de los mecanismos de segregación normales, mantenerse y replicarse dentro de las células tumorales?
Un nuevo estudio publicado en la prestigiosa revista Cell por un equipo de investigadores de los Institutos de Tecnología Avanzada de Shenzhen y colaboradores desvela una conexión sorprendente y crucial: la persistencia del ecDNA depende íntimamente de que la propia célula detecte y responda al daño en el ADN.
Utilizando modelos celulares innovadores (generados con tecnología CRISPR para crear ecDNA artificialmente) y sistemas ya establecidos, los científicos investigaron el ciclo de vida del ecDNA.

Los autores descubrieron que:
- La Replicación del ecDNA Causa Daño: El propio proceso de copiar el ecDNA, debido a su naturaleza circular y a la alta actividad de replicación y transcripción que ocurre en él, genera estrés físico en la molécula de ADN. Esto provoca roturas frecuentes en el ADN, especialmente roturas de doble cadena (DSBs), que son un tipo de daño genético grave. Enzimas clave como las topoisomerasas (TOP1 y TOP2B), que normalmente ayudan a manejar la estructura del ADN, parecen estar implicadas en la generación de estas roturas en el ecDNA.

- El Daño Activa la Alarma Celular (DDR): Estas roturas en el ecDNA activan el sistema de respuesta al daño del ADN (DDR) de la célula, una red de proteínas diseñada para detectar y reparar el ADN roto. Específicamente, se activa la vía liderada por la proteína ATM, un sensor clave de DSBs.
- ¡La Reparación es Necesaria para Mantener el ecDNA! (La Paradoja): Aquí viene lo inesperado. En lugar de simplemente eliminar el ecDNA dañado, la célula tumoral utiliza la maquinaria del DDR activada para mantener y asegurar la persistencia del ecDNA. El estudio identificó que una vía de reparación específica llamada unión de extremos no homólogos alternativa (alt-NHEJ), que involucra a proteínas como LIG3 y POLθ, es fundamental para este mantenimiento. ¡Es como si el ecDNA necesitara “romperse” un poco para que la célula “se dé cuenta” y lo mantenga activo!
- Una Vulnerabilidad Terapéutica: Esta dependencia del DDR crea un talón de Aquiles en los tumores con ecDNA. Los investigadores demostraron que inhibir componentes clave del DDR (como ATM o las quinasas CHK) o las topoisomerasas (TOP1/TOP2B) perjudica selectivamente la supervivencia y el mantenimiento del ecDNA en las células cancerosas, haciéndolas más vulnerables.

Conclusión: Nuevas Estrategias Contra el Cáncer Agresivo
Este trabajo desvela una interacción fundamental y paradójica: la replicación y mantenimiento del ecDNA en tumores están intrínsecamente acoplados a la activación de las vías de respuesta al daño del ADN. El ecDNA necesita “herirse” para activar la maquinaria celular que, a su vez, le permite persistir. Este descubrimiento no solo nos ayuda a entender mejor cómo funcionan algunos de los cánceres más difíciles, sino que también identifica al sistema DDR como una diana terapéutica prometedora para tratar específicamente los tumores que albergan ecDNA. ¡Atacar el sistema de reparación podría ser la clave para eliminar el ADN “extra” que hace a estos cánceres tan peligrosos!
Referencia: Kang, X., Li, X., Zhou, J., et al. (2025). Extrachromosomal DNA replication and maintenance couple with DNA damage pathway in tumors. Cell, 188, 1–17. DOI: 10.1016/j.cell.2025.04.012 (Nota: El DOI y fecha exacta de publicación final pueden variar)
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.