¡Tu carrito está actualmente vacío!
Más Allá del Cáncer: La Terapia CAR-T Podría Dejar una “Niebla Cerebral” Persistente, Pero Hay Esperanza para Revertirla
La Revolución CAR-T y un Desafío Emergente
La terapia con células T con receptores de antígenos quiméricos (CAR-T) ha revolucionado el tratamiento de ciertos tipos de cáncer, especialmente las neoplasias hematológicas. Al “reprogramar” las propias células T del sistema inmunitario de un paciente para que reconozcan y ataquen a las células cancerosas, esta inmunoterapia ha logrado tasas de remisión sin precedentes en pacientes que antes tenían pocas opciones. Sin embargo, a medida que más pacientes sobreviven gracias a estas terapias innovadoras, emerge una preocupación sobre sus posibles efectos a largo plazo, particularmente en la función cognitiva. Un nuevo estudio publicado en la prestigiosa revista Cell por Anna C. Geraghty, Michelle Monje y un equipo de investigadores de Stanford y otras instituciones, ha utilizado modelos de ratón para desentrañar los mecanismos detrás de este “deterioro cognitivo relacionado con la inmunoterapia”, revelando una persistente neuroinflamación como culpable y, crucialmente, identificando posibles estrategias para revertirlo.
El Problema: Cuando la Lucha Contra el Cáncer Afecta al Cerebro
Los supervivientes de cáncer tratados con quimioterapia o radioterapia craneal a menudo reportan lo que se conoce como “quimiocerebro” o “niebla cerebral”, un síndrome caracterizado por déficits en la memoria, la atención, la velocidad de procesamiento y la función ejecutiva. Los primeros informes sugieren que las inmunoterapias, a pesar de sus mecanismos de acción muy diferentes, también podrían aumentar el riesgo de síntomas cognitivos persistentes.
El equipo de investigación se centró en la terapia CAR-T y se preguntó si esta, al eliminar tumores tanto dentro como fuera del sistema nervioso central (SNC), podría inducir cambios duraderos en el cerebro que afecten la cognición.
Modelos de Ratón Revelan un Patrón Preocupante
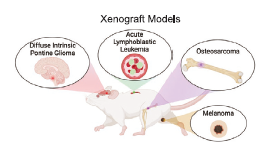
Para investigar esto, utilizaron varios modelos de ratón con cánceres humanos (xenoinjertos) que incluían:
- Un glioma de línea media difuso (DIPG, un cáncer cerebral agresivo).
- Leucemia linfoblástica aguda (LLA).
- Dos tipos de osteosarcoma (un cáncer de hueso), uno de “eliminación rápida” y otro “agresivo”.
- Un modelo inmunocompetente de melanoma.

En estos modelos, los ratones fueron tratados con células CAR-T diseñadas para eliminar sus respectivos tumores. Lo que encontraron fue consistente en los modelos donde se observaron déficits cognitivos:
- Deterioro Cognitivo: Los ratones tratados con terapia CAR-T que eliminaba eficazmente el tumor (en los modelos de DIPG, LLA y osteosarcoma agresivo) mostraron un rendimiento deficiente en pruebas de comportamiento que evalúan la atención, la memoria a corto plazo (prueba de reconocimiento de objetos novedosos) y la memoria de trabajo espacial (laberinto en T). Es importante destacar que los ratones de control con tumor, pero tratados con células T simuladas (sin CAR) o CAR-T no dirigidas al tumor no mostraron estos déficits, lo que sugiere que no es el tumor en sí mismo, sino la respuesta a la terapia CAR-T, lo que causa el problema.
- Neuroinflamación Persistente: Incluso un mes después de que el tumor había sido eliminado, estos ratones mostraban signos de neuroinflamación persistente en el SNC. Esto incluía:
- Elevación de Citoquinas y Quimiocinas en el LCR: El líquido cefalorraquídeo (LCR) mostró niveles elevados de moléculas proinflamatorias como eotaxina/CCL11, CCL2, CCL7 y CXCL10.
- Reactividad Microglial en la Sustancia Blanca: La microglia (las células inmunes residentes del cerebro) en las regiones de sustancia blanca (tractos de axones mielinizados) se volvió reactiva de forma persistente. Sus números aumentaron y mostraron un perfil transcripcional alterado, similar al observado en enfermedades inflamatorias como la esclerosis múltiple.
- Disrupción de Células Neurales Clave: Esta neuroinflamación tuvo consecuencias en otras células cerebrales:
- Oligodendrocitos Afectados: Hubo una disminución en el número de células precursoras de oligodendrocitos (OPCs) y de oligodendrocitos maduros (las células que producen mielina) en la sustancia blanca subcortical. La mielina es crucial para la comunicación neuronal rápida.
- Neurogénesis Hipocampal Reducida: La producción de nuevas neuronas en el hipocampo, una región clave para la memoria, también se vio disminuida.
Curiosamente, el modelo de osteosarcoma de “eliminación rápida”, que no mostró deterioro cognitivo, tampoco mostró esta persistente elevación de citocinas ni reactividad microglial, lo que sugiere que no es la interacción CAR-T/tumor per se, sino la respuesta inmune más amplia y sostenida la que desencadena los problemas cognitivos.
Validación en Pacientes Humanos
Para confirmar si estos hallazgos en ratones podrían ser relevantes para los humanos, los investigadores analizaron muestras de tejido cerebral post-mortem de pacientes con DIPG que habían recibido terapia CAR-T GD2. Encontraron que la microglia de estos pacientes también mostraba estados reactivos transcripcionales similares a los observados en los modelos de ratón, y los oligodendrocitos también presentaban alteraciones. Esto valida la utilidad de los modelos animales para estudiar este fenómeno.
¡Hay Esperanza! Bloqueando la Neuroinflamación para Rescatar la Cognición
El hallazgo más esperanzador del estudio es que estos efectos perjudiciales podrían ser reversibles. Sabiendo que la microglia reactiva y ciertas quimiocinas (como CCL11, liberada por la microglia) juegan un papel central:
- Depleción Microglial: Cuando los investigadores eliminaron temporalmente la microglia de los ratones después de la terapia CAR-T (usando un inhibidor del receptor CSF1R como PLX5622), observaron una normalización de las poblaciones de oligodendrocitos y una restauración del rendimiento cognitivo en la prueba de reconocimiento de objetos novedosos. Esto posiciona a la microglia reactiva como un actor central en la disfunción.
- Bloqueo del Receptor de Quimiocinas CCR3: CCR3 es un receptor para CCL11 y CCL24 (ambas elevadas). Cuando se trató a los ratones con un inhibidor de CCR3 que puede cruzar la barrera hematoencefálica, también se rescataron los déficits en oligodendrocitos y la función cognitiva.
Implicaciones y Futuro: Hacia Terapias CAR-T Más Seguras para el Cerebro
Este estudio es crucial porque:
- Identifica un Problema Real: Confirma que la terapia CAR-T, a pesar de sus beneficios, puede tener secuelas cognitivas a largo plazo debido a la neuroinflamación persistente.
- Desvela Mecanismos: Señala a la reactividad de la microglia de la sustancia blanca y a la señalización de quimiocinas (particularmente a través de CCR3) como mediadores clave de estos efectos.
- Ofrece Dianas Terapéuticas: Sugiere que la depleción transitoria de la microglia o el bloqueo de receptores de quimiocinas como CCR3 podrían ser estrategias viables para prevenir o tratar el deterioro cognitivo inducido por la inmunoterapia.
- Unifica Principios de “Niebla Cerebral”: Los mecanismos observados (reactividad microglial, disfunción de oligodendrocitos, neurogénesis alterada) son sorprendentemente similares a los que se observan después de la quimioterapia, la radioterapia craneal e incluso algunas infecciones virales, lo que sugiere principios neuroinmunes compartidos para diferentes tipos de “niebla cerebral”.

Conclusión: Un Paso Adelante Hacia la Optimización de la Calidad de Vida
Si bien el riesgo de efectos cognitivos a largo plazo es un precio que muchos pacientes estarían dispuestos a pagar por una terapia que salva vidas como la CAR-T, optimizar la calidad de vida de los supervivientes es de suma importancia. El trabajo de Geraghty, Monje y su equipo no solo ilumina los mecanismos subyacentes al deterioro cognitivo relacionado con la inmunoterapia, sino que, lo que es más importante, abre la puerta a intervenciones terapéuticas específicas que podrían mitigar estos efectos secundarios, permitiendo a los pacientes no solo sobrevivir al cáncer, sino también prosperar después de él.
Referencia del Artículo:
Geraghty, A. C., Acosta-Alvarez, L., Rotiroti, M. C., Dutton, S., O’Dea, M. R., Kim, W., … & Monje, M. (2025). Immunotherapy-related cognitive impairment after CAR T cell therapy in mice. Cell, 188, 1–21. https://doi.org/10.1016/j.cell.2025.03.041
(Fecha de publicación prevista: 12 de junio de 2025).
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.