¡Tu carrito está actualmente vacío!
¡Desafiando el Espejo de la Vida! Proteína Ancestral Muestra Sorprendente “Ambidextrismo” para Unirse al ADN
En el intrincado baile molecular que es la vida, existe una regla fundamental: la quiralidad, o la “lateralidad” de las moléculas, similar a nuestras manos izquierda y derecha. Las proteínas de los seres vivos están hechas casi exclusivamente de L-aminoácidos (la forma “izquierda”), mientras que los azúcares en nuestro ADN y ARN son D-azúcares (la forma “derecha”). Esta consistencia es crucial; cambiar la “mano” de una molécula biológica generalmente significa que ya no encajará ni funcionará correctamente, como intentar poner un guante izquierdo en una mano derecha.
Sin embargo, un equipo de científicos, incluyendo a Orit Weil-Ktorza, Segev Naveh-Tassa, Yaakov Levy, Norman Metanis y Liam M. Longo, ha descubierto una sorprendente excepción a esta regla en un antiguo y fundamental dominio de unión a ácidos nucleicos, el motivo hélice-horquilla (hairpin)-hélice (HhH). Su trabajo, dedicado a la memoria de su colega Dan S. Tawfik, revela una “ambidextrismo funcional” que desafía nuestras expectativas sobre la especificidad quiral.
En Pocas Palabras
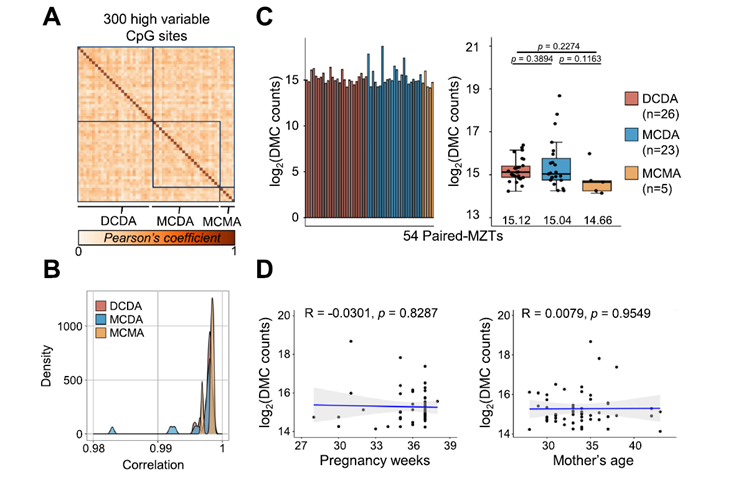
Los investigadores analizaron la trayectoria evolutiva completa de un antiguo elemento de unión a ácidos nucleicos, el motivo HhH, desde un péptido flexible hasta un dominio plegado, para estudiar su robustez funcional frente a la inversión quiral total (crear su imagen especular). Sorprendentemente, observaron una “ambidextrismo funcional”: tanto los péptidos HhH simples interactuando con ARN como el dominio HhH plegado uniéndose a ADN de doble cadena (dsDNA) mantenían su función incluso cuando su quiralidad o la de su pareja era invertida. Análisis detallados y simulaciones moleculares revelaron un solapamiento en los modos de unión de las proteínas naturales y sus imágenes especulares al dsDNA natural. Estos hallazgos resaltan una inesperada robustez en esta familia de proteínas y sugieren que la barrera entre mundos con preferencias quirales alternativas podría no ser tan infranqueable como se pensaba.

El Viaje de una Proteína Ancestral: Del ARN al ADN
El motivo HhH es un bloque de construcción proteico muy antiguo y común, esencial para que las proteínas se unan al material genético. Los científicos estudiaron este motivo en diferentes etapas de su supuesta evolución:
- Como un péptido HhH simple y flexible, que se sabe interactúa con el ARN formando gotitas (un proceso llamado separación de fases).
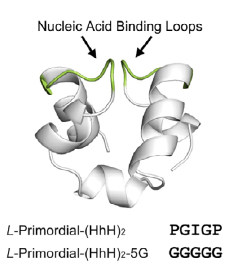
- Como un dominio (HhH)₂-Fold más estructurado y plegado (una duplicación del motivo HhH), que se une específicamente al surco menor del ADN de doble cadena.
La gran pregunta era: ¿qué pasaría si se invirtiera la quiralidad de estos componentes? Es decir, si se crearan versiones “espejo” de los péptidos y dominios HhH (hechos con D-aminoácidos en lugar de los L-aminoácidos naturales) y se probaran con ARN y ADN naturales (hechos con D-azúcares) o incluso con ADN “espejo” (hecho con L-azúcares).

La Sorpresa: Funcionalidad a Través del Espejo
Los resultados fueron realmente asombrosos y rompieron con las expectativas:
- Ambidextrismo con el ARN: Los péptidos HhH, tanto en su forma natural (L-aminoácidos) como en su forma especular (D-aminoácidos), fueron capaces de interactuar con el ARN natural y formar gotitas. ¡La inversión quiral del péptido no abolió esta función primitiva!
- Ambidextrismo con el ADN: Aún más notable fue que el dominio plegado (HhH)₂-Fold, cuando se sintetizó con D-aminoácidos (la forma especular), ¡aún podía unirse al ADN natural (D-dsDNA)! Aunque la unión natural (L-proteína con D-dsDNA) y su imagen especular perfecta (D-proteína con L-dsDNA) eran, como se esperaba, las más fuertes, la capacidad de la D-proteína para reconocer el ADN natural fue una revelación.
Simulaciones por dinámica molecular y análisis cinéticos detallados sugirieron que existe un solapamiento en la forma en que la proteína natural y su versión especular se unen al ADN natural. Parece que, aunque la evolución ha optimizado una forma de unión de alta afinidad (la natural), podrían persistir modos de unión más primitivos y “ambidiestros”, especialmente en dominios tan antiguos. La presencia de un ion metálico que actúa como puente en la unión también parece ser clave para esta flexibilidad.
¿Por Qué Es Importante Este Descubrimiento?
Este hallazgo sobre el “ambidextrismo funcional” del motivo HhH y el dominio (HhH)₂-Fold tiene implicaciones profundas:
- Nuevas Perspectivas sobre la Evolución Temprana: Sugiere que las primeras interacciones entre proteínas y ácidos nucleicos en los albores de la vida podrían haber sido menos estrictas en cuanto a quiralidad de lo que se pensaba. Esta flexibilidad podría haber sido una ventaja en un mundo prebiótico donde quizás ambas quiralidades de moléculas estaban presentes.
- Robustez de Dominios Ancestrales: Demuestra que algunos dominios proteicos muy antiguos pueden retener una robustez funcional sorprendente, una especie de “memoria” de modos de interacción más versátiles.
- Diseño de Nuevas Moléculas: Comprender cómo algunas proteínas pueden interactuar con parejas quirales no naturales podría inspirar el diseño de nuevas herramientas biotecnológicas o terapéuticas con propiedades únicas (por ejemplo, proteínas D que son resistentes a la degradación por las enzimas del cuerpo).
- El Origen de la Homiquiralidad: Aunque no resuelve el misterio de por qué la vida eligió una quiralidad sobre la otra, sí sugiere que la transición a un mundo homoiral podría haber coexistido con interacciones más “permisivas”.

Este trabajo nos recuerda que la naturaleza, especialmente en sus formas más ancestrales, puede ser mucho más adaptable y sorprendente de lo que imaginamos. El “espejo” entre los mundos quirales de la biología podría tener más reflejos y conexiones de los que habíamos considerado hasta ahora.
Referencia
Weil-Ktorza, O., Naveh-Tassa, S., Fridmann-Sirkis, Y., Despotović, D., Cherukuri, K. P., Corlett, T., Levy, Y., Metanis, N., & Longo, L. M. (2025). Functional Ambidexterity of an Ancient Nucleic Acid-Binding Domain. Angewandte Chemie International Edition, e202505188. (Artículo original previsto para publicación en 2025, según la información proporcionada). https://doi.org/10.1002/anie.202505188
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.