¡Tu carrito está actualmente vacío!
Más Frío, Más Claro: Desvelan Cómo Obtener Imágenes Atómicas de Moléculas de la Vida a Temperaturas Extremas
La criomicroscopía electrónica (cryo-EM) ha revolucionado nuestra capacidad para ver las diminutas máquinas moleculares de la vida – como las proteínas – con un detalle casi atómico y sin la necesidad de generar cristales como en el caso de la cristalografía de rayos X. Sin embargo, esta técnica tiene un límite fundamental: el propio haz de electrones necesario para tomar la imagen daña irreversiblemente la muestra. Una forma de mitigar este daño por radiación es enfriar la muestra a temperaturas criogénicas, típicamente usando nitrógeno líquido (LN2, unos -196 °C u 80 Kelvin).
Pero la teoría y experimentos previos con cristales sugerían que enfriar aún más, hasta temperaturas de helio líquido (LHe, cerca del cero absoluto, ~ -260 °C o 13 Kelvin), debería reducir el daño por radiación de 2 a 5 veces más, permitiendo obtener imágenes mucho más nítidas. El problema era que, durante décadas, todos los intentos de aplicar esto a muestras individuales (la técnica estándar de cryo-EM de partícula única) habían fracasado. Misteriosamente, las imágenes a LHe no eran mejores, y a menudo eran peores, que a LN2. ¿Por qué?
Un equipo de investigadores del prestigioso Laboratorio de Biología Molecular del MRC en Cambridge, Reino Unido, finalmente ha resuelto este enigma. Su estudio, publicado en PNAS, identifica las causas físicas detrás de este fracaso y demuestra una solución ingeniosa.
El Misterio del Movimiento a Bajas Temperaturas
Los científicos descubrieron que el principal culpable era el movimiento de la muestra durante la exposición al haz de electrones, pero de una forma inesperada:
- “Crio-arrugamiento” del Soporte: El problema no era tanto que las moléculas flotaran en el hielo, sino que la propia rejilla metálica (usualmente de oro) sobre la que se congela la muestra se movía físicamente. Al enfriar de LN2 a LHe, el metal se contrae de forma diferente al hielo ultrafino que lo recubre, generando una tensión que “arruga” la lámina metálica. Luego, el calor del haz de electrones relaja esta tensión durante la toma de la imagen, provocando que la lámina se aplane y ¡mueva toda la muestra!

- El Hielo se Expande, No Colapsa: Contrario a lo que se pensaba, el hielo amorfo congelado no colapsa a una forma más densa bajo el haz a estas temperaturas extremas. ¡De hecho, los investigadores encontraron evidencia de que se expande ligeramente! Este sutil hinchamiento del hielo también contribuía a empujar y mover las moléculas durante la toma de la imagen.
La Solución: Agujeros Pequeños y Haces Enfocados
Conociendo las causas, la solución fue una combinación de nanoingeniería y óptica electrónica:
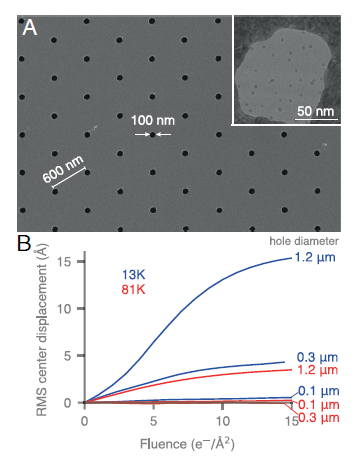
- Rejillas con Nano-agujeros: Fabricaron rejillas de oro especiales con agujeros muchísimo más pequeños de lo habitual (100 nanómetros de diámetro en lugar de los 1-2 micrómetros típicos).

- Haz de Electrones Contenido: Utilizaron un haz de electrones enfocado, ligeramente más grande que los nano-agujeros pero más pequeño que el diámetro típico, para iluminar solo el área de interés dentro del agujero.
Esta combinación logró eliminar por completo el movimiento de la muestra. Los pequeños agujeros impedían el “crio-arrugamiento” a gran escala del soporte, y el haz pequeño minimizaba los efectos de relajación y expansión del hielo.

El Resultado: Imágenes Atómicas Sin Precedentes a Helio Líquido
¡Y funcionó! Por primera vez, el equipo demostró que, eliminando el movimiento, la cryo-EM a temperaturas de helio líquido sí ofrece la mejora teórica esperada en la reducción del daño por radiación. Cada imagen (o “frame”) capturada a 13 K contenía significativamente más información de alta resolución que las obtenidas a 80 K. Lograron determinar estructuras de proteínas con mayor detalle usando menos partículas.
Este avance técnico abre la puerta a estudiar moléculas más pequeñas, más frágiles o en estados conformacionales más difíciles de capturar, empujando las fronteras de lo que podemos “ver” en la biología estructural. Aunque presenta nuevos desafíos para la preparación de muestras, el camino hacia imágenes atómicas aún más claras está ahora despejado gracias a la comprensión y control de la física a temperaturas extremas.
Referencia: Dickerson, J.L., Naydenova, K., Peet, M.J., et al. (2025). Reducing the effects of radiation damage in cryo-EM using liquid helium temperatures. PNAS, 122 (17) e2421538122. DOI: 10.1073/pnas.2421538122 (Nota: Fecha exacta de publicación final puede variar)
AI bacterias Biología Sintética CRISPR cáncer envejecimiento Escherichia coli evolución Microbioma microbiota regulación resistencia salud VIH virus
Ultimos Productos
-
Curso de Organismos Modelo en Biología Molecular Febrero 2025
El precio original era: $75.00.$57.00El precio actual es: $57.00. -
Masterclass: Dinámica y Composición de los Condensados Biomoleculares
El precio original era: $80.00.$60.00El precio actual es: $60.00.
Buscar
Últimos Posts
Últimos Comentarios
Categorías
Archivos
- marzo 2026 (5)
- febrero 2026 (15)
- enero 2026 (21)
- diciembre 2025 (20)
- noviembre 2025 (16)
- octubre 2025 (21)
- septiembre 2025 (17)
- agosto 2025 (17)
- julio 2025 (19)
- junio 2025 (24)
- mayo 2025 (26)
- abril 2025 (49)
- marzo 2025 (20)
- febrero 2025 (10)
- enero 2025 (7)
- diciembre 2024 (8)
- noviembre 2024 (23)
- octubre 2024 (7)
Palabras clave
Sígue las noticias
Te invitamos a registrar tus datos como tu correo electrónico para que puedas recibir las últimas noticias y anuncios de Biología Molecular México

By signing up, you agree to the our terms and our Privacy Policy agreement.